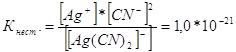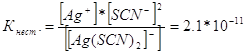| Главная » Статьи » Химия | [ Добавить статью ] |
Контрольная работа: Химические формулы соединений
КОНТРОЛЬНАЯ РАБОТА ПО ХИМИИ
14. В каком количестве Сг(ОН)з содержится столько же эквивалентов, сколько в 174,96 г Мg(ОН)2? Молярная масса гидроксида магния составляет 58,32 г/моль, а эквивалентная масса - 29,16 г/моль. Следовательно, в массе гидроксида магния 174,96 г содержится 174,96 г : 29,16 г/моль = 6 моль-экв. Молярная масса эквивалента гидроксида хрома (Ш) составляет 1/3 М Сг(ОН)з или 34,34 г/моль, а 6 моль-экв этого вещества составят 34,33г/моль х 6 моль = 205,98 г. Таким образом, в 205,98 г Сг(ОН)з содержится столько же эквивалентов, сколько в 174,96 г Мg(ОН)2. 34. Сколько и какие значения может принимать магнитное квантовое число ml при орбитальном квантовом числе l=0,1,2,3? Какие элементы в периодической системе называются s-,р-, d-, f- элементами? Приведите примеры Число значений магнитного квантового числа зависит от орбитального квантового числа и равно (21 + 1), где 1 - орбитальное квантовое число. Поэтому при l=0 ml=0, при l=1 ml принимает значения -1,0, +1; при 1=2 ml принимает значения -2,-1, 0,+1,+2; при =3 ml может принимать значения -3,-2,-1, 0, +1,+2,+3. Химические элементы, в атомах которых происходит заполнение электронами s-,р-, d-, f- орбиталей соответственно, называются s-,р-,d-,f-элементами. Например, к s-элементам относятся Н, Не, а также щелочные и щелочно-земельные металлы (металлы 1А и 11А -групп- Na, К, RЬ, Ве. Са, Мg, Sг и др.) К р- элементам относятся например, элементы которыми завершаются периоды в периодической системе элементов (кроме первого периода) - В, С, N, Nе, J, Сl, Вг, Р, S, F, Аs, Sе, Аг, Rn, Те и др. К d-элементам относятся элементы расположенные в больших периодах между s-элементами и р- элементами, например, Fе, Мn, Сг, Тi, Мо, Рt,Со,Ru, Rh и др. К f-элементам относятся лантаноиды например, Се, Nd, Рm, Sm, Еu, Gd, и актиноиды, например, Тh, U, Nр, Рu, Аm и др. 54. Какую низшую степень окисления проявляет водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в этой степени окисления. Как называются соответствующие соединения? Атом водорода имеет единственный валентный электрон. Поэтому низшая степень окисления водорода будет равна -1 (атом водорода принимает 1 электрон от другого элемента). Эту низшую степень окисления +2 -1 водород проявляет в соединении СаН2. Это соединение называется гидрид кальция. Атом фтора имеет семь валентных электронов, до завершения энергетического уровня недостает одного электрона. Поэтому низшая (и единственная) степень окисления фтора -1. Соединения фтора в этой +2 -1 степени окисления называются фторидами. Например, СаF2 - фторид кальция. Атом серы имеет шесть валентных электронов, до завершения энергетического уровня не достает двух электронов. Поэтому низшая степень окисления серы равна -2. Соединения серы в этой степени окисления +2 -2 называются сульфидами. Например, СаS - сульфид кальция. Атом азота имеет пять валентных электронов, до завершения энергетического уроня не достает трех электронов. Поэтому низшая степень окисления азота равна -3. Соединения азота в этой степени окисления +2 -3 называются нитридами. Саз N2 -нитрид кальция. 74. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность в соединениях: СН4; СН3ОН; НСООН; СО2 Под степенью окисления понимается условный заряд атома в соединении, вычисленный из предположения что оно состоит только из ионов. Степень окисления может принимать отрицательное, положительное и нулевое значение, представлять целое или дробное число. Алгебраическая сумма степеней окисления атомов в соединении всегда равна нулю, а в сложном ионе - заряду иона. В приведенных соединения углерода атом углерода четырехвалентен. А вот степень окисления атома углерода в данных соединениях различна. В метане - СН4 - степень окисления углерода - 4. В метаноле - СНзОН - степень окиления углерода - 2 в муравьиной кислоте НСООН - степень окисления углерода +2, в диоксиде углерода - СО2 - степень окисления углерода +4. 94. При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН (ж). Ответ: -277,67 кДж С2Н5ОН (ж) + 3 О2 (г) = 2 СО2 (г) + 3 Н2О (п) 1 моль жидкого этилового спирата имеет массу 46 г. Для составления термохимического уравнения составим пропорцию: 11,5 г этанола ——————————— 308,71 кДж 46 г этанола ———————————— х кДж
Тогда термохимическое уравнение метана примет вид: С2Н5ОН (ж) + 3 02 (г) = 2 С02 (г) + 3 Н2О (п); ∆Н° = -1234,84 Тепловой эффект реакции записываем со знаком «минус», так как теплота в ходе реакции выделяется. По закону Гесса тепловой эффект реакции не зависит от пути перехода, а зависит только от конечного и начального состояния системы. ∆Н° реакции = ∑∆Н° обр конеч. - ∑∆Н° обр нач Стандартные энтальпии образования исходных веществ и продуктов реакции берем из справочника: ∆Н°обр СО2(г) = -393,51 кДж/моль, ∆Н°обр Н2О(пар) = -241,83 кДж/моль ∆Н°обр О2(г) = 0 кДж/моль. Отсюда ∆Н°обр (С2Н5ОН (ж))= [∆Н°обр (Н2О) *3 + ∆Н°обр (СО2) *2] - ∆Н°реакции = [(-241,83)*3 + (- 393,51)*2 - (-1234, 84) = - 277,68 кДж/моль
114. Какие из карбонатов: ВеСОз, СаСОз или ВаСОз - можно получить при действии соответствующих оксидов с СО2? Какая реакции идет наиболее энергично? Вывод сделайте вычислив ∆G°298 реакций Возьмем по справочнику стандартные значения энергии Гиббса ∆G°298 для исходных веществ и конечных продуктов реакций: ∆G°298 ВеО = -569,54 кДж/моль, ∆G°298 ВеСОз = -944,75, ∆G°298 ВаО = -525,84 кДж/моль, ∆G°298 ВаСО3 = -1132,77 кДж/моль; ∆G°298 СаО = -603,46 кДж/моль, ∆G°298 СаСО3 = -1128,35 кДж/моль; ∆G°298 СО2 = -394,37 кДж/моль; Тогда для реакции ВеО(к) + СО2(г) = ВеСОз(к) стандартное значение энергии Гиббса составит: -944,75-[(-569,54)+(-394,37)]=+19,16кДж/моль. Положительное значение энергии Гиббса для данной реакции указывает, что в стандартных условиях данная реакция протекает преимущественно справа налево и кабонат бериллия из ВеО и СО2 получить нельзя. Для реакции ВаО(к) + СО2(г) = ВаСОз(к) стандартное значение энергии Гиббса составит: -1132,77-[(-525,84)+(-394,37)]=-212,56кДж/моль/ Для реакции СаО(к) + СО2(г) = СаСОз(к) стандартное значение энергии Гиббса составит: -1128,35-[(-603,46)+(-394,37)]=-130,52 кДж/моль.
Значение энергии Гиббса для данных реакций отрицательное и данные процессы протекают в прямом направлений, то есть получить карбонаты кальция и бария таким путем можно. Наиболее энергично будет протекать реакция между оксидом бария и углекислым газом, поскольку значение энергии Гиббса для этой реакции будет иметь наиболее отрицательное значение. 134. Равновесие гомогенной системы 4 НСl(г)+О2(г) ↔ 2Н20(г)+2Сl2(г) установилось при следующих концентрациях реагирующих веществ моль/л: [Н2О]р=0,14; [Сl2]р =0,14; [НСl]Р = 0,20; [О2]р = 0,32. Вычислите исходные концентрации хлороводорода и кислорода Дано: [Н20]р = 0,14 моль/л [Сl2]р =0,14 моль/л [НСl]Р = 0,20 моль/л [О2]р = 0,32 моль/л [HCI]исх=? [O2] исх=? Исходя из уравнения реакции весь хлор (2моль) образуется из хлороводорода (4моль), а вся вода - из исходного хлороводорода и кислорода. Следовательно, чтобы образовалось 0,14 моль хлора должно вступить в реакцию 0,28 моль хлороводорода, а чтобы получить 0,14 моль воды нужно, чтобы в реакцию вступило 0,07 моль кислорода. Таким образом, исходная концентрация НСl составляла 0,20+0,28=0,48 моль/л, а исходная концентрация О2 была равна 0,32+0,07=0,39 моль/л. Ответ: Исходные концентрации хлороводорода и кислорода составляют соответственно 0,48 моль/л и 0,39 моль/л.
154. На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50см3 раствора кислоты. Вычислите молярную концентрацию эквивалента раствора кислоты Найдем титр раствора КОН:
Теперь вычислим молярную концентрацию эквивалента раствора КОН:
Зная величину молярной концентрации эквивалента, раствора КОН вычислим молярную концентрацию эквивалента кислоты:
отсюда
174. Сколько граммов мочевины СО(NН2)2 следует растворить в 75г воды, чтобы температура кристаллизации раствора понизилась на 0,465°? Криоскопическая константа воды равна 1,86 Молярная масса мочевины равна 60 г/моль. Понижение температуры замерзания раствора ∆ТК = 0,465 °С. По закону Рауля понижение температуры кристаллизации раствора по сравнению с температурой кристаллизации чистого растворителя зависит от криоскопической константы растворителя и моляльной концентрации растворенного вещества. Отсюда можно вычислить массу растворенного вещества - мочевины в растворе.
194. Составьте молекулярные и ионно-молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями Fе(ОН)з + 3 Н+ = Ре3+ + 3 Н2О Сd2+ + 2 ОН- = Сd(ОН)2 Н+ + NO2- =HNO2 Fе(ОН)3 (т)+ 3 НСl = FеС13 + 3 Н2О Fе(ОН)3 (т) + 3 Н+ + 3 Сl- = Fе3+ + ЗСl- + 3 Н2О Fе(ОН)3 (т) + 3 Н+ = Fе3+ + 3 Н2О Сd(NOз)2+ 2 КОН = Сd(ОН)2 (т)+ 2 КNО3 Cd2+ + 2NO3 +2К+ +2OH- = Сd(ОН)2 (т)+ 2 К+ + 2 NО3- Сd2 + 2 ОН- = Сd(ОН)2 (т)
НС1 + NaNО2 = НNО2 + NaС1 Н+ + Сl- + Nа+ + NO2- = НNО2 + Nа+ + Сl- H+ +NО2 - =HNO2 214. При смешивании А12(SО4)з и Nа2СОз каждая из взятых солей гидролизуется необратимо с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями А12(SО4)з + 3 Nа2СО3 + 3 Н2О → 2 А1(ОН)3(т) + 3 Nа2SО4 + ЗСО2(г) 2 А13+ + 3 SО42- + 6 Nа+ + ЗСО32- + 3 Н2О → 2 Fе(ОН)3 (т) + 6 Nа+ + 3 SО42- + ЗСО2(г) 2 А13+ + ЗСО32- + 3 Н2О → 2 А1(ОН)3 (т) + ЗСО2(г) 254. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов на аноде и катоде. (-)Fе |Н2S04| |Н2S04|Аg(+) На аноде (железо) протекает процесс Fе-2 ё = Fе2+, электроны по проводнику переходят на серебряную пластину и на поверхности серебра катоде протекает процесс
2 Н+ + 2 ё = Н2 Т ↑. Железная пластина будет растворяться, а на серебряной пластине будет наблюдаться выделение водорода. 274. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора КВr. Какая масса вещества выделяется на катоде и аноде, если электролиз проводить в течение 1 ч 35 мин при силе тока 15 А? Ответ: 0,886г; 70,79г При электролизе водного раствора бромида калия с инертными (графитовыми) электродами на катоде протекает процесс восстановления молекул воды и выделяется водород: 2Н2О+2ё =Н2↑ +2О1H- На аноде протекает процесс окисления бромид-ионов и выделяется бром: 2Вг- - 2ё =Вг2 Молярная масса эквивалента водорода равна 1 г/моль, а молярная масса эквивалента брома равна 79,904 г/моль. Тогда по законам Фарадея можно найти массу водорода и брома, которые выделяются соответственно на катоде и на аноде.
294. Какой металл целесообразнее выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Каков состав продуктов коррозии? При протекторной защите протектор - более активный металл, чем металл защищаемой конструкции служит анодом и разрушается тем самым предохраняет от разрушения конструкцию. Поэтому, чем более отрицательный будет потенциал металла-протектора, тем эффективнее будет протекторная защита. Наиболее низкий потенциал будет у магния -2,37В, (у цинка - 0,763 В; у хрома - 0,74 В) Так как оболочка кабеля сделана из свинца, то гальваническая пара магний - свинец будет иметь наибольшую разность потенциалов. И магний будет служить наилучшей протекторной защитой. При атмосферной коррозии на поверхности магниевого протектора протекает процесс: 2Mg – 4ё = 2Mg2+ Электроны по проводнику переходят на свинцовый кабель и на поверхности свинца происходит кислородная деполяризация: О2 + 2 Н2О + 4ё = 4 ОН- Продуктом атмосферной коррозии будет гидроксид магния 2 Мg2+ + 4 ОН- = 2 Мg(ОН)2
314. Напишите выражения для констант нестойкости следующих комплексных ионов: [Аg(СN)2]-; [Аg(NН3)2]+; [Аg(SСМ)2]-. Зная, что они соответственно равны 1,0*10-21, 6,8*10-8, 2,1*10-11, укажите в каком растворе, содержащем эти ионы, при равной молярной концентрации ионов Аg+ больше? Запишем выражения константы нестойкости для данных комплексных ионов:
При данной температуре величина константы нестойкости есть величина постоянная. Чем меньше константа нестойкости, тем устойчивее комплекс, поэтому наибольшая концентрация ионов серебра будет в растворе, содержащем комплексный ион [Аg(NНз)2]+. |
Чтобы скачать материал, пожалуйста, авторизуйтесь или зарегистрируйтесь! Это быстро ! )
Категории
| Математика, алгебра, геометрия [1729] |
| Книги (Это интересно) [351] |
| Видеоуроки [26920] |
| География [2660] |
| Дополнительное образование [401] |
| ЕГЭ/ГИА [266] |
| Информатика [1187] |
| История / обществознание [4663] |
| Для Логопеда [500] |
| Материалы для коррекц. классов [400] |
| ОБЖ [558] |
| Презентации [402] |
| Для Психолога [514] |
| Физическая культура [529] |
| Черчение [121] |
| Шаблоны презентаций [466] |
| Для Библиотекаря [160] |
| Праздники [419] |
| Интересные Видеоролики [12] |
| Английский язык [791] |
| Иностранные языки (прочие) [461] |
| Окружающий мир [873] |
| Биология и экология [1643] |
| Всем учителям [508] |
| Для директора и завуча [1042] |
| Дошкольное образование [1238] |
| Искусство [804] |
| Для Классного руководителя [543] |
| Начальные классы [718] |
| Основы религиозных культур [137] |
| Программы и Софт [21] |
| Родной язык [505] |
| Русский язык и литература [3915] |
| Технология [1000] |
| Физика [1263] |
| Химия [1297] |
| Экономика [905] |
| Астрономия [444] |
| Писатели [113] |
| Классный час [527] |
| Шаблоны документов [85] |
| Другое (Прочее) [412] |